Jakość i bezpieczeństwo terapii żywieniowej z punktu widzenia farmaceuty szpitalnego
Udostępnij

W ostatnich latach na farmaceutów szpitalnych nałożono wiele nowych obowiązków, w tym udział w terapii żywieniowej. Głównym priorytetem farmaceutów w tym zakresie jest zapewnienie bezpiecznej, ukierunkowanej na pacjenta, terapii w ramach żywienia dojelitowego i pozajelitowego.
Do obowiązków farmaceutów należy organizowanie zaopatrzenia szpitala w leki czy wyroby medyczne niezbędne do prowadzenia terapii żywieniowej. Dzięki fachowej wiedzy na temat składu dostępnych na rynku preparatów i wskazań do ich stosowania, farmaceuta może być partnerem lekarza i aktywnie uczestniczyć w doborze odpowiedniej diety, monitorowaniu zarówno postępów leczenia, jak i działań niepożądanych, ocenie ryzyka wystąpienia interakcji oraz w rozwiazywaniu problemów lekowych.
Co więcej, farmaceuci szpitalni są odpowiedzialni za sporządzanie mieszanin do żywienia pozajelitowego. Wykorzystanie wiedzy z zakresu technologii postaci leku, wprowadzenie zasad Dobrej Praktyki Wytwarzania oraz wykorzystanie innowacyjnego sprzętu gwarantuje jakość i bezpieczeństwo wytworzonego leku.
Specjalizacja z żywienia klinicznego stwarza farmaceucie wiele możliwości spełnienia zawodowego, ale wymaga od niego nie tylko szerokiej fachowej wiedzy teoretycznej i praktycznej, lecz także znajomości aktualnych wytycznych i wdrażania ich w codziennej pracy w celu zapewnienia pacjentom odpowiedniej opieki farmaceutycznej.
Leczenie żywieniowe
Leczenie żywieniowe stanowi nieodłączny element nowoczesnej terapii chorych, a pokrycie zapotrzebowania na składniki odżywcze ma istotny wpływ na poprawę wyników leczenia, redukcję liczby powikłań, skrócenie czasu hospitalizacji i obniżenie kosztów leczenia [1].
Leczenie żywieniowe polega na podaży białka, źródeł energii, elektrolitów, witamin, pierwiastków śladowych w ilościach zaspokajających zapotrzebowanie dobowe, dostosowanych do możliwości metabolicznych pacjenta i obejmuje:
- żywienie dojelitowe:
- drogą naturalną (doustną) przez: modyfikację diety doustnej; wzbogacanie diety doustnej dietami cząstkowymi zawierającymi jeden składnik odżywczy: białko, węglowodany lub tłuszcz; stosowanie żywności specjalnego przeznaczenia medycznego jako uzupełnienie diety doustnej lub jako jedyne źródło pożywienia pod warunkiem pełnego pokrycia zapotrzebowania na składniki odżywcze;
- przez sztuczny dostęp: zgłębnik nosowo-żołądkowy, nosowo-jelitowy, nosowo-dwunastniczy lub przez przetokę odżywczą, dietami przemysłowymi należącymi do kategorii żywności specjalnego przeznaczenia medycznego;
- żywienie pozajelitowe polegające na podaży składników odżywczych drogą dożylną (żyły obwodowe lub centralne),
- łączone żywienie pozajelitowo-dojelitowe, które polega na tym, że część zapotrzebowania na energię i składniki odżywcze zostaje zaspokojona drogą dożylną, a pozostała część – drogą dojelitową [1, 2].
W celu zapewnienia prawidłowego leczenia żywieniowego, w ramach swoich kompetencji zawodowych farmaceuta szpitalny jest zobowiązany do:
- zamawiania, przechowywania oraz dostarczania preparatów i sprzętu do żywienia zgodnie z potrzebami pacjentów szpitala,
- sporządzania mieszanin do żywienia pozajelitowego,
- kontroli i konsultacji składu mieszaniny żywieniowej pod kątem jej bezpieczeństwa,
- monitorowania działań niepożądanych produktów leczniczych i wyrobów medycznych,
- konsultacji farmakoterapii przez sztuczne dostępy żywieniowe [1, 3].
Ponadto w przypadku realizacji usług w ramach procedury żywienia w warunkach domowych, farmaceuta posiadający certyfikat ukończenia kursu z zakresu leczenia żywieniowego w warunkach domowych zwykle odpowiada również za:
- organizację dostaw preparatów i sprzętu do żywienia,
- edukację pacjenta i/lub opiekuna w zakresie: odpowiedniego przechowywania mieszanin,
- przygotowania mieszaniny do podania,
- postępowania w sytuacjach awaryjnych [1, 3].
Realizacja powyższych obowiązków to trudne wyzwanie wymagające nie tylko szerokiego zakresu fachowej wiedzy teoretycznej, ale również praktycznej. Poniżej przedstawiono kluczowe aspekty terapii żywieniowej z punktu widzenia farmaceuty szpitalnego.
Zamawianie
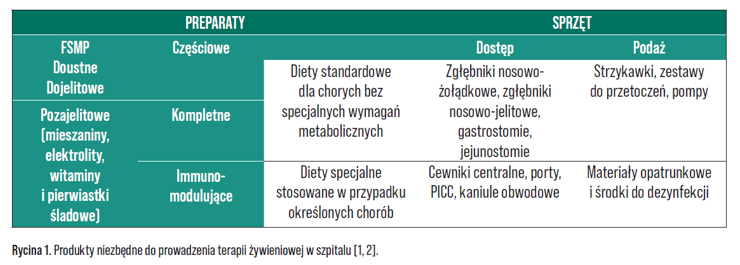
Jednym z podstawowych zadań farmaceuty w szpitalu jest zaopatrzenie oddziałów w produkty lecznicze i wyroby medyczne. W kontekście terapii żywieniowej będzie to: żywność specjalnego przeznaczenia medycznego (FSMP, ang. food for special medical purposes) w postaci diet doustnych czy dojelitowych, mieszaniny do żywienia pozajelitowego, witaminy i pierwiastki śladowe, elektrolity i płyny infuzyjne, a także sprzęt i wyroby medyczne niezbędne zarówno do wytworzenia sztucznego dostępu oraz opieki nad nim, jak i do podawania diety. Na rynku omówiono produkty różniące się składem, przeznaczeniem, postacią i funkcjonalnością, niezbędne do prowadzenia terapii żywieniowej w szpitalu (Rycina 1.) [1, 2].
Należy pamiętać, że tylko właściwy dobór preparatu do problemu zdrowotnego pacjenta, z uwzględnieniem jego aktualnego stanu, gwarantuje uzyskanie zamierzonego celu żywieniowego [1]. Dlatego niezwykle ważne jest wprowadzenie do receptariusza szpitalnego zróżnicowanych preparatów doustnych, dojelitowych i pozajelitowych oraz zapewnienie ich dostępności. Podstawową zasadą jest racjonalizacja terapii z dostosowaniem jej do profilu szpitala na podstawie:
- specyfikacji pacjentów szpitala (z uwzględnieniem grup wiekowych dorośli/dzieci/niemowlęta i noworodki),
- specyfikacji oddziałów (związanej ze specjalnościami medycznymi oraz rodzajem udzielanych świadczeń),
- specyfikacji ilości (miesięcznych/ rocznych – istotne nie tylko w kontekście umowy dostawy oraz zamówień, ale także posiadania odpowiednich zapasów).
Znajomość składu dostępnych na rynku preparatów i wskazań do ich stosowania w odpowiednich grupach chorych jest potrzebna nie tylko do przygotowania specyfikacji asortymentowej, ale również do pracy klinicznej. Farmaceuta może być partnerem lekarza i aktywnie uczestniczyć w doborze odpowiedniej diety, monitorować postępy leczenia oraz działania niepożądane, sprawdzać ryzyko wystąpienia interakcji pomiędzy stosowanym leczeniem farmakologicznym a żywieniem klinicznym, a także rozwiązywać problemy lekowe.
Preparaty do żywienia mogą być zamawiane i wydawane zarówno na zabezpieczenie oddziału, zwłaszcza standardowe diety FSMP, elektrolity, witaminy, pierwiastki śladowe oraz materiały medyczne umożliwiające włączenie wsparcia żywieniowego całodobowo, jak i na podstawie recepty indywidualnej dla konkretnego pacjenta. W praktyce recepty indywidualne stosuje się w przypadku mieszanin do żywienia pozajelitowego (wzór recepty określają standardy Polskiego Towarzystwa Farmaceutycznego – PTFarm) czy specjalistycznych diet FSMP przeznaczonych dla pacjentów z określonymi schorzeniami oraz wszystkich preparatów dla pacjentów domowych, gwarantując tym samym racjonalizację i bezpieczeństwo terapii. Zasady zleceń, terminy realizacji i częstotliwość dostaw powinny być określone w wewnętrznych procedurach szpitala z uwzględnieniem organizacji pracy na oddziałach i w labolatorium oraz godzin pracy apteki szpitalnej.
Przechowywanie
Wyroby medyczne, FSMP oraz większość produktów leczniczych można przechowywać w kontrolowanej temperaturze pokojowej (do +25°C) w terminie oznaczonym przez producenta.
Wyjątek stanowią gotowe mieszaniny do żywienia pozajelitowego oraz niektóre preparaty witamin, które należy przechowywać w lodówce z kontrolowaną temperaturą w zakresie +2 do +8°C zgodnie z terminem przydatności oznaczonym na etykiecie. Preparaty zawierające aminokwasy, emulsję tłuszczową, witaminy czy pierwiastki śladowe należy chronić przed światłem. Właściwe warunki przechowywania mają duże znaczenie dla zachowania odpowiedniej jakości produktów leczniczych, ograniczając nie tylko ryzyko mikrobiologiczne, ale i ryzyko wystąpienia interakcji oraz rozkładu substancji czynnych [3].
Dostarczanie
Gotowe mieszaniny do żywienia pozajelitowego, przygotowane w aptece szpitalnej, wymagają specjalnych warunków transportu. Powinny być transportowane w pojemnikach izotermicznych z wkładami chłodniczymi, które zapewniają temperaturę od +2 do +8°C (zwłaszcza w przypadku mieszanin wykonanych na zapas oraz w procedurze żywienia domowego). Pozostałe preparaty i wyroby nie wymagają szczególnych warunków [3].
Sporządzanie mieszanin do żywienia pozajelitowego
Za sporządzanie mieszanin żywieniowych dożylnych zgodnie z farmaceutycznymi standardami sporządzania mieszanin do żywienia pozajelitowego Polskiego Towarzystwa Farmaceutycznego uważa się:
- przygotowanie mieszanin według recepty lekarskiej, z pojedynczych składników (aminokwasów, węglowodanów, emulsji tłuszczowej, mikroelementów i witamin) w warunkach aseptycznych pracowni żywienia,
- suplementację przemysłowych worków wielokomorowych (tzw. RTU, ang. ready to use) według zleceń lekarskich, w warunkach aseptycznych, z wykorzystaniem loży z nawiewem laminarnym, w aptece szpitalnej [1, 3].
Farmaceuta odpowiedzialny za sporządzanie mieszanin do żywienia musi znać obowiązujące standardy i wymagania farmakopealne stawiane tej postaci leku oraz Zasady Dobrej Praktyki Wytwarzania, aby zapewnić odpowiednią jakość leku i bezpieczeństwo pacjentów [3, 4]. Pomyłka lub zakażenie mieszaniny na etapie sporządzania może stanowić poważne zagrożenie dla zdrowia lub życia pacjenta [6]. Istotne dla zapewnienia jakości jest opracowanie procedur i instrukcji opisujących każdą czynność podczas sporządzania mieszanin, co gwarantuje powtarzalność procesu oraz – w razie potrzeby – szybką analizę błędów. Nie mniej ważna od zapewnienia jakości jest rutynowa kontrola zarówno gotowych mieszanin oraz warunków ich sporządzania, jak i personelu.
Wybór metody sporządzania mieszanin zależy od warunków strukturalnych szpitala oraz potrzeb pacjenta. Obie metody są tak samo skuteczne. Niemniej jednak, chociaż stosowanie worków RTU jest zwykle korzystniejsze pod względem ekonomicznym, to stosowanie worków indywidualnych jest konieczne u pacjentów ze specjalnymi potrzebami (np. noworodki, dzieci, pacjenci z dużym zapotrzebowaniem elektrolitowym, niewydolnością wątroby, nerek).
Przygotowanie mieszanin wg recepty lekarskiej, z pojedynczych składników, może odbywać się metodą manualną lub z wykorzystaniem automatycznych pomp sterowanych komputerowo. Zalety metody automatycznej to: bezpieczeństwo, wydajność oraz kompletna dokumentacja procesu, zgodna ze aktualnymi standardami (PTFarm oraz FP XI), natomiast główną wadą są codzienne koszty uruchomienia pomp [3, 4]. Szacuje się, że w przypadku średniego zapotrzebowania, wynoszącego 15 mieszanin dziennie, opłacalne jest sporządzanie ich metodą automatyczną z pojedynczych składników [5]. W przypadku mniejszego zapotrzebowania lub braku możliwości organizacyjnych, należy zapewnić dostęp do mieszanin indywidualnych z pracowni żywienia pozajelitowego innego szpitala na podstawie umowy.
Kontrola i konsultacja składu mieszaniny żywieniowej pod kątem jej bezpieczeństwa
Kontrola bezpieczeństwa mieszaniny żywieniowej powinna obejmować aspekt farmaceutyczny – bezpieczeństwo leku oraz kliniczny – bezpieczeństwo pacjenta. Pod względem farmaceutycznym należy sprawdzić, czy zlecone składniki mieszaniny, ich ilość i rodzaj nie będą źródłem potencjalnych niezgodności, a także czy nie zostały przekroczone stężenia graniczne składników mieszaniny na podstawie iloczynów stężeń oraz dostępnych badań stabilności.
W przypadku worków wielokomorowych należy skontrolować zgodność z zaleceniami producentów w zakresie ilości, asortymentu dodawanych składników (tabele suplementacji dostępne na życzeniu u producenta oraz w farmaceutycznych standardach sporządzania mieszanin do żywienia pozajelitowego PTFarm) [1, 3]. Natomiast w aspekcie klinicznym należy zweryfikować, czy osmolarność mieszaniny jest prawidłowa z punktu widzenia drogi podania oraz czy dawkowanie składników jest zgodne z wytycznymi. W przypadku przekroczenia dawek, farmaceuta powinien skonsultować skład z lekarzem, czy zlecone dawkowanie jest uzasadnione klinicznie, czy też wynika z błędu lub pomyłki zlecającego [15].
Monitorowanie działań niepożądanych produktów leczniczych i wyrobów medycznych
Obowiązek monitorowania działań niepożądanych przez farmaceutów wynika z ustawy o izbach aptekarskich, Prawa farmaceutycznego oraz rozporządzenia Ministra Zdrowia [4, 8, 9]. Odpowiedni udział farmaceutów w procesie monitorowania bezpieczeństwa terapii żywieniowej może znacząco wspomóc weryfikację występowania działań niepożądanych u pacjenta oraz zwiększyć ich zgłaszalność, a w konsekwencji doprowadzić do podniesienia poziomu efektywności i bezpieczeństwa leczenia żywieniowego.
Dobrze znane działania niepożądane związane z terapią żywieniową obejmują mechaniczne skutki uboczne, takie jak niedrożność cewnika i zakażenia związane z cewnikiem, zaburzenia metaboliczne, takie jak hiperglikemia i hipertrójglicerydemia oraz zakażenia. Dożylne podanie emulsji lipidowych i nadmiar węglowodanów mogą zwiększyć ryzyko hipertriglicerydemii, hipercholesterolemii, hiperglikemii i cholestazy. Ponadto dożylna podaż aminokwasów może wywołać zwiększenie stężenia azotu mocznikowego we krwi, zasadowicę metaboliczną, hiperamonemię, stupor i inne zaburzenia neurologiczne, zwłaszcza u pacjentów z niewydolnością nerek lub wątroby.
Częstymi objawami niepożądanymi obserwowanymi po podaży żywienia pozajelitowego są: zaburzenia żołądkowo-jelitowe (nudności, wymioty), świąd skóry i wysypka, zaburzenia ośrodkowego i obwodowego układu nerwowego (zawroty głowy) oraz tachykardia [10]. Podczas prowadzenia żywienia enteralnego mogą wystąpić objawy nietolerancji ze strony przewodu pokarmowego, takie jak: nudności, wymioty, biegunki, zaleganie żołądkowe i zaparcia [11].
Konsultacja farmakoterapii przez sztuczne dostępy żywieniowe
Do podania leków pacjentowi żywionemu dojelitowo można wykorzystać sztuczny dostęp, ale zwykle wiąże się to ze stosowaniem leków poza wskazaniami rejestracyjnymi i wymaga zgody pacjenta. Używanie leku w sposób niezgodny z charakterystyką produktu leczniczego (ChPL) jest związane z większym ryzykiem oraz z dodatkową odpowiedzialnością. Taka forma farmakoterapii powinna podlegać ocenie farmaceuty, który oszacuje skuteczność podania leku, biorąc pod uwagę takie czynniki, jak: miejsce wchłaniania substancji leczniczej, miejsce założenia zgłębnika, średnicę zgłębnika, rodzaj podawanego leku, ewentualne interakcje pomiędzy podawanymi lekami oraz pomiędzy lekiem a dietą [12].
Prawidłowa ocena farmakoterapii prowadzona przez farmaceutę może zapobiec groźnym powikłaniom w żywieniu dojelitowym, przyczynić się do zminimalizowania ryzyka pojawienia się działań niepożądanych oraz interakcji lekowych i niezgodności pomiędzy lekami a składnikami diet, a także uszkodzenia dostępu.
Rozwiązaniem problemów lekowych może być: alternatywne leczenie, wykorzystujące inne, ale zgodne z ChPL, drogi podania leku (np. transdermalna, doodbytnicza, pozajelitowa, wziewna) lub inne dostępne leki generyczne o odpowiedniej postaci lub odpowiedniki farmaceutyczne i terapeutyczne, które można podawać bez zmiany postaci leku. W przypadku braku możliwości zmiany leku można zaproponować schemat podaży zapewniający odpowiednią skuteczność leku oraz minimalizujący ryzyko wystąpienia działań niepożądanych [12].
Jednoczesne stosowanie leków doustnych przez pacjentów żywionych pozajelitowo zazwyczaj nie jest przeciwwskazane, jednak pacjenci wymagający takiego wsparcia zwykle cierpią na ciężką czynnościową lub anatomiczną niewydolność przewodu pokarmowego, ograniczającą możliwości wchłaniania jelitowego. Zaburzenia wchłaniania wpływają na losy leków w ustroju, prowadząc do niepewnej ich biodostępności lub jej braku, dlatego decydując się na podawanie leków doustnych tej grupie chorych należy wybrać odpowiednią postać leku.
Najlepiej wchłaniane są substancje lecznicze podawane w postaci roztworu, syropu, zawiesiny. Jednak leki w tej formie zwykle są przeznaczone dla dzieci i wymagają podania dużych objętości, aby osiągnąć odpowiednią dawkę, oraz mają dużą osmolarność, co może powodować działania niepożądane, takie jak biegunki, wymioty czy bóle brzucha. W przypadku stałych form leków najlepsze są tabletki rozpadające się w jamie ustnej lub te przeznaczone do rozgryzania czy żucia.
Z tradycyjnych form warto wybierać takie, które można kruszyć, rozpuszczać w płynach czy wysypać z kapsułek, zwłaszcza w przypadku pacjentów, u których w stomii pojawiają się niezmienione tabletki. Należy unikać form o modyfikowanym uwalnianiu (powolnym, kontrolowanym lub przedłużonym) [13].
Interakcje pomiędzy lekami doustnymi a żywieniem pozajelitowym są rzadkie. Najczęściej obserwowany klinicznie jest antagonizm witaminy K zawartej w preparatach witaminowych oraz w emulsji tłuszczowej z lekami przeciwzakrzepowymi, dlatego u pacjentów leczonych antagonistami witaminy K po włączeniu żywienia pozajelitowego należy kontrolować INR i dostosować odpowiednio dawki leków. Ponadto żywienie pozajelitowe wzmacnia prozapalne cytokiny i hamuje aktywność enzymów cytochromu CYP450, np. glutamina hamuje CYP3A i CYP2C. Co więcej, uszkodzenie wątroby spowodowane żywieniem pozajelitowym może również wpływać na wątrobowy metabolizm leków [14]. Wszystkie te aspekty należy rozważyć włączając nowe leki w grupie pacjentów otrzymujących żywienie pozajelitowe.
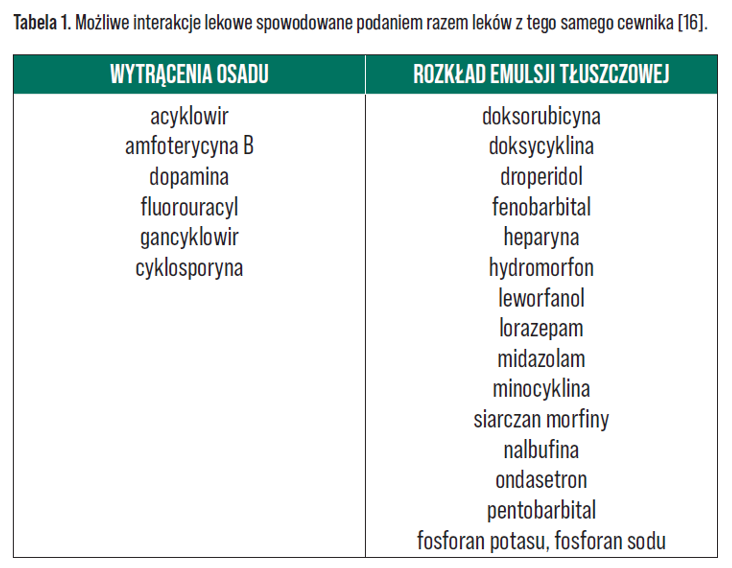
Oprócz wymienionych interakcji farmakokinetycznych i farmakodynamicznych, mieszaniny do żywienia pozajelitowego mogą wchodzić w interakcje farmaceutyczne o charakterze niezgodności oraz utraty stabilności z innymi lekami podanymi dożylnie. Najczęstsze to: wytrącanie osadu, problemy z rozpuszczalnością, rozdział faz emulsji tłuszczowej, utrata aktywności leku i/lub składników odżywczych.
Przykładami są: reakcja Maillarda pomiędzy aminokwasami a glukozą, fotodegradacja, utlenianie i hydroliza witamin (tiamina, witamina A, kwas askorbinowy) czy glikozylacja z utratą aktywności oktreotydu [15]. W związku z dużym ryzykiem generalnie nie zaleca się dodawania leków do mieszanin odżywczych bez wcześniejszego potwierdzenia ich zgodności. W razie konieczności dostrzykiwania leków do mieszanin, najlepiej korzystać z przemysłowych worków wielokomorowych RTU opierając się na tabelach stabilności producenta [1].
W praktyce klinicznej najczęściej podaje się leki w osobnym wlewie. Należy jednak pamiętać, że również jednoczasowe podawanie leków z osobnych pojemników tym samym cewnikiem niesie ze sobą ryzyko wystąpienia interakcji – Tabela 1 [16]. Najczęstsze powi kłania po wystąpieniu reakcji niezgodności leków z mieszaniną odżywczą to: utrata drożności cewnika, zatory naczyń oraz niepowodzenie terapii. Dlatego dobrą praktyką jest stosowanie osobnego wkłucia do żywienia pozajelitowego lub stosowanie cewników wieloświatłowych z kanałem przeznaczonym do żywienia, aby zapobiec mieszaniu się roztworów i pojawieniu się niezgodności [16].
Podsumowanie
Świadomość posiadania kompetencji zawodowych daje podstawę do szerszego spojrzenia na stosowanie terapii żywieniowej i pozwala na wdrażanie nowych standardów, natomiast prawidłowe wykonywanie obowiązków farmaceuty szpitalnego gwarantuje bezpieczeństwo pacjentów, co stanowi klucz do wysokiej jakości opieki.
Autorka:
mgr farm. Magdalena Piętka
Szpital Wielospecjalistyczny im. Stanleya Dudricka w Skawinie
Artykuł został opublikowany na łamach 52. Wydania kwartalnika Farmakoekonomika Szpitalna
Źródła:
- Polskie Towarzystwo Żywienia Pozajelitowego, Dojelitowego i Metabolizmu: Standardy żywienia dojelitowego i pozajelitowego. Wyd. 1. Kraków: Scientifica, 2014.
- Sobotka L.: Podstawy żywienia klinicznego. Wyd. 4. Kraków: Scientifica, 2013.
- Balcerzak E., Chmal-Jagiełło K., Ciszewska-Jędrasik M., Górecka A. i wsp.: Farmaceutyczne standardy sporządzania mieszanin do żywienia pozajelitowego Polskiego Towarzystwa Farmaceutycznego. Wyd. 2. Kraków: Scientifica, 2017.
- Farmakopea Polska Wydanie XI (FP XI 2017) monografia: Leki sporządzane w aptece.
- Bozat E., Korubuk G., Onar P., Abbasoglu O.: Cost Analysis of Premixed Multichamber Bags versus Compounded Parenteral Nutrition: Breakeven Point. Hospital Pharmacy. 2014. Vol. 49, No. 2, 170-176.
- Guenter P., Ayers P., Boullata J.I., Gura K.M., Holcombe B., Sacks G.S.: Parenteral Nutrition Errors and Potential Errors Reported Over the Past 10 Years. Nutrition in Clinical Practice. 2017. Vol. 32, No. 6, 826-830.
- Ustawa z dnia 19 kwietnia 1991 r. o izbach aptekarskich. Dz.U. 1991 nr 41 poz. 179. http://isap.sejm.gov.pl/isap.nsf/ DocDetails.xsp?id=WDU19910410179 (stan z dn. 20.08.2020 r.).
- Ustawa z dnia 6 września 2001 r. Prawo farmaceutyczne. Dz.U. 2001 nr 126 poz. 1381. https://isap.sejm.gov.pl/isap.nsf/ DocDetails.xsp?id=WDU20011261381 (stan z dn. 20.08.2020 r.).
- Rozporządzenie Ministra Zdrowia z dnia 17 lutego 2003 r. w sprawie monitorowania bezpieczeństwa produktów leczniczych. Dz.U. 2003 nr 47 poz. 405. http://isap.sejm.gov.pl/isap.nsf/DocDetails.xsp?id=WDU20030470405 (stan z dn. 20.08.2020 r.).
- Eum S., Ock M., Lee S., Kim H.: Adverse events and concurrent medications associated with parenteral nutrition use. Basic & Clinical Pharmacology & Toxicology. 2019. Vol. 124, No. 2, 154-162.
- Różowicz A., Jakubczyk M., Kusza K., Spychalska K. i wsp.: Czynniki wpływające na występowanie działań niepożądanych ze strony przewodu pokarmowego podczas prowadzenia żywienia dojelitowego u pacjentów oddziału intensywnej terapii. Przegląd Gastroenterologiczny. 2013. Wyd. 8, nr 1, 62-67.
- Ciszewska-Jędrasik M., Cichowlas A., Adamowicz O., Sieradzki E.: Rekomendacje dotyczące podawania leków w żywieniu enteralnym. Zasady postępowania. Interakcje. Warszawa: Fresenius Kabi Polska Sp. z o.o., 2013.
- Ciszewska-Jędrasik M., Gabrowska E., Górecka A., Kłęk S. i wsp.: Żywienie pozajelitowe w domu. Podręcznik dla pacjentów. Wyd. 1. Kraków: Scientifica, 2016.
- Shaw A.A., Hall S.D., Franklin M.R., Galinsky R.E.: The influence of L-glutamine on the depression of hepatic cytochrome P450 activity in male rats caused by total parenteral nutrition. Drug Metabolism and Disposition. 2002. Vol. 30, No. 2, 177-182.
- Stawny M., Olijarczyk R., Jaroszkiewicz E., Jelińska A.: Pharmaceutical point of view on parenteral nutrition. Scientific World Journal. 2013. Vol. 2013, 415310.
- Trissel L.A., Gilbert D.L., Martinez J.F., Baker M.B., Walter W.V., Mirtallo J.M.: Compatibility of medications with 3-in- 1 parenteral nutrition admixtures. Journal of Parenteral and Enteral Nutrition. 1999. Vol. 23, No. 2, 67-74.