Komercyjny i poza komercyjny dostęp do innowacyjnych leków sierocych
Udostępnij

Pojęcie leków sierocych zostało po raz pierwszy wprowadzone do powszechnego użycia w 1983 roku w Stanach Zjednoczonych. Od tego czasu tysiące chorych na choroby rzadkie uzyskało dostęp do innowacyjnych terapii, które niejednokrotnie ratowały im życie. Choć w Polsce sytuacja chorych ulega systematycznej poprawie, tempo niektórych zmian pozostawia jeszcze wiele do życzenia. W rezultacie niezwykle ważny z perspektywy cierpiących oraz ich rodzin jest dostęp do opcji terapeutycznych, które pozostają w naszym kraju nierefundowane systemowo, oraz do tych, które nie uzyskały jeszcze dopuszczenia do obrotu.
Na początku stycznia bieżącego roku minęło 40 lat od przyjęcia w Stanach Zjednoczonych Aktu o Lekach Sierocych (ang. Orphan Drug Act [1]) – pierwszej tego typu inicjatywy legislacyjnej na świecie, która bezpośrednio dotykała obszaru chorób rzadkich.
Od tego czasu wspólną politykę dotyczącą leków sierocych wdrożyła w państwach członkowskich Unia Europejska (w 1999 roku [2]), a po drodze jeszcze Japonia (w 1993 roku [1]) oraz Australia (w 1997 roku [2]). Skutkiem tych działań było stworzenie zupełnie nowego segmentu rynku farmaceutycznego, czyli segmentu leków sierocych.
Był to też czas dynamicznego rozwoju biologii molekularnej, w tym genomiki oraz proteomiki, które pozwoliły na identyfikację i klasyfikację kolejnych chorób rzadkich. Chociaż prawdą jest, że znakomita większość chorób rzadkich pozostaje bez dedykowanych im leków lub jest niewłaściwie leczona, pełny obraz tej trudnej sytuacji jest zdecydowanie bardziej skomplikowany.
Choroba rzadka – definicja
Zgodnie z definicją europejską schorzenie uznaje się za rzadkie, jeśli dotyka nie więcej niż 5 na 10 000 osób [1]. Pod tą wydawałoby się prostą i jednoznaczną definicją kryją się jednak duże różnice, ponieważ nie wszystkie choroby rzadkie są w jednakowym stopniu rzadkie.
Jak bardzo niejednolita pod względem chorobowości jest ta grupa schorzeń może świadczyć fakt, że jedynie 4% aktualnie zdefiniowanych chorób rzadkich mieści się w przedziale 1-5 chorych na 10 000 populacji, podczas gdy aż 84% dotyka mniej niż 1 na 1 000 000 osób [2]. Innymi słowy, 80% wszystkich pacjentów z rzadkimi chorobami cierpi na jedną ze 150 najczęściej występujących chorób (Rysunek 1.).
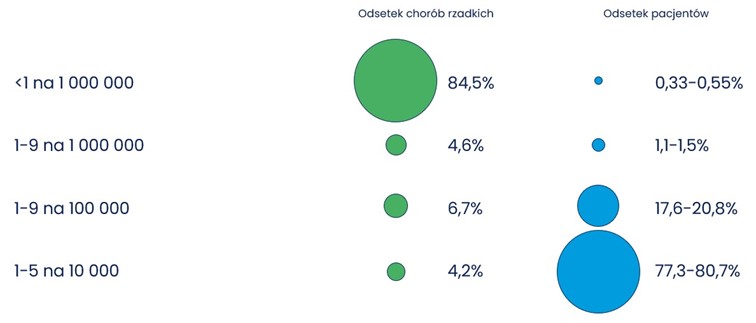
Zdjęcie 1. Dystrybucja chorób rzadkich oraz pacjentów na różnych poziomach chorobowości
Mając na względzie perspektywę utylitarną nie powinno zatem zaskakiwać, że niemal wszystkie te schorzenia mają opracowany i zatwierdzony lek. Jednak nawet w takiej sytuacji dostępność innowacyjnych terapii jest ograniczona.
Dostępność innowacyjnych terapii sierocych
W ujęciu ogólnym dostępność produktów leczniczych powinno rozpatrywać się na dwóch płaszczyznach. Pierwsza z nich zakłada, że produkt jest dopuszczony i wprowadzany do obrotu, druga natomiast dotyczy kwestii jego finansowania.
W rezultacie o produkcie leczniczym możemy powiedzieć, że jest dostępny, jeśli każdy pacjent, który winien dany produkt leczniczy stosować, będzie w stanie bez przeszkód systemowych i finansowych wejść w jego posiadanie.
Podstawowym źródłem finansowania terapii chorób rzadkich w Polsce są programy lekowe, w ramach których chorzy uzyskują bezpłatny dostęp do innowacyjnych i najczęściej ponadprzeciętnie drogich produktów leczniczych.
Oprócz szczegółowego opisu sposobu podawania i dawkowania leków oraz procedury monitorowania leczenia programy lekowe zawierają także kryteria kwalifikacji do leczenia.
W opublikowanym w lipcu 2022 roku raporcie dotyczącym dostępności innowacyjnych terapii w Europie (ang. EFPIA Patients W.A.I.T. Indicator 2021 Survey [6]) wykazano, że z 57 leków sierocych dopuszczonych do obrotu w latach 2017-2022 w Polsce refundowanych systemowo jest jedynie 8 (14%).
Dla porównania średnia dla krajów Unii Europejskiej wynosi 21 leków (37%) [3]. Zdecydowanie nie jest to wynik, który satysfakcjonuje środowisko medyczne, a dla chorych i ich rodzin jest po prostu nie do zaakceptowania.
Innym wskaźnikiem, który charakteryzuje dostępność innowacyjnych terapii, jest czas, w jakim firma uzyskuje pozytywną decyzję refundacyjną. W tym przypadku wynik Polski (średnio 993 dni od dopuszczenia do obrotu) również pozostawia wiele do życzenia [3].
Warto w tym miejscu jednak podkreślić, że nie jest to jedynie wina funkcjonujących w naszym kraju rozwiązań systemowych. Co prawda średnia czasu od dopuszczenia leku sierocego do obrotu do objęcia go refundacją wynosi niespełna trzy lata, jednak przeciętna firma proces ten – przynajmniej formalnie – rozpoczyna z niemal 24 miesięcznym opóźnieniem.
Choć zdecydowanie łatwiej za taki stan rzeczy winić niezależne przecież decyzje firm, w rzeczywistości sytuacja wydaje się nieco bardziej skomplikowana.
Pomimo faktu, że leki innowacyjne podlegają tzw. rejestracji centralnej, decyzje dotyczące polityki refundacyjnej oraz cen podejmowane są na szczeblu krajowym z uwzględnieniem specyfiki systemu opieki zdrowotnej w danym kraju.
Przy tak silnym rozdrobnieniu rzeczą zupełnie naturalną jest stosowanie przez firmy farmaceutyczne swoistej priorytetyzacji. Nierzadko firmom brakuje zasobów, aby w tym samym czasie przystąpić do procesów refundacyjnych we wszystkich 27 państwach członkowskich.
W konsekwencji firmy, dokonując wyboru, kierują się szeregiem różnych kryteriów, z których do najczęściej powtarzających się należą: łatwość negocjacji warunków cenowych czy wielkość populacji wyrażona w poprawnie zdiagnozowanych chorych.
Identyfikacja pacjentów
W tym miejscu przechodzimy do innej nie mniej ważnej kwestii, czyli do identyfikacji pacjentów. Pacjenci cierpiący na choroby rzadkie bardzo często muszą przebyć długą i krętą drogę, aby ostatecznie uzyskać prawidłową diagnozę i rozpocząć leczenie.
Ten żmudny i nastręczający chorym oraz ich rodzinom wielu problemów proces nazywany jest odyseją diagnostyczną. Nierzadko od pojawienia się pierwszych objawów do poprawnej diagnozy mija niestety wiele lat.
Wszystkie te trudności wynikają z niewielkiej liczby chorych, ograniczonego dostępu do doświadczonych specjalistów oraz niskiej świadomości społecznej w obszarze chorób rzadkich.
W konsekwencji wielu firmom biofarmaceutycznym, zwłaszcza tym mniejszych rozmiarów, identyfikacja pacjentów przysparza sporych trudności. Przekłada się to na problemy w oszacowaniu wielkości potencjalnego rynku i dalej na problemy z opracowaniem skutecznej strategii komercyjnej.
Dlatego też tak ważna jest każda inicjatywa, która wpływa na identyfikację pacjentów. Choć inicjatywy te mogą być realizowane na wielu płaszczyznach i przez różne narzędzia, to najbardziej porządne przez środowiska pacjenckie są te, które wspomagają dostęp do innowacyjnych, lecz systemowo nierefundowanych terapii [5].
W Polsce w przypadku leków nierefundowanych systemowo, ale dopuszczonych do obrotu narzędziem pozwalającym na ich finansowanie jest Ratunkowy Dostęp do Technologii Lekowych (RDTL).
To stosunkowo młody – bo wprowadzony w 2017 roku – system wydawania indywidualnych zgód na leczenie pacjentów, dla których wyczerpano wszystkie dostępne opcje terapeutyczne finansowane ze środków publicznych.
Uchwalona 7 października 2020 roku Ustawa o Funduszu Medycznym [7] zmodyfikowała ten system, a główną zmianą było przeniesienie decyzyjności z poziomu Ministerstwa Zdrowia oraz Agencji Oceny Technologii Medycznych i Taryfikacji na poziom szpitali leczących pacjentów oraz konsultantów krajowych i wojewódzkich [4].
Programy wczesnego dostępu
W przypadku leków innowacyjnych, w tym tych stosowanych w chorobach rzadkich, istnieją także alternatywne sposoby uzyskania do nich dostępu przez chorych. Jednym z nich są tzw. programy wczesnego dostępu.
Prawodawstwo unijne dopuszcza w tym zakresie trzy podstawowe możliwości:
a) zastosowanie leku podyktowane współczuciem (ang. compassionate use),
b) zastosowanie leku na imienny wniosek (ang. treatment on a named-patient basis),
c) programy rozszerzonego dostępu (ang. expanded access programs).
Choć rozwiązania te w głównej mierze dotyczą leków, które nie uzyskały jeszcze dopuszczenia do obrotu, w wielu krajach członkowskich znane są przypadki, kiedy programem wczesnego dostępu objęte były leki już zarejestrowane.
Zastosowanie leku podyktowane współczuciem
Zastosowanie leku podyktowane współczuciem to legalna forma dostępu do leku, który nie został jeszcze dopuszczony do obrotu, a co do którego zgromadzone dane o skuteczności pozwalają przypuszczać, że pomógłby on odnieść korzyść kliniczną u pacjentów, dla których nie ma innych opcji terapeutycznych.
W praktyce, leki które formalnie pozostają w trakcie badań, trafiają przeważnie do pacjentów, którzy nie mogą zostać zakwalifikowani do badania klinicznego [8].
Prawo wspólnotowe jest w tym zakresie na tyle elastyczne, że pozwala poszczególnym krajom członkowskim na indywidualne kształtowanie polityki lekowej w tym zakresie.
Co jednak warte odnotowania, europejski regulator zapewnia możliwość zwrócenia się z wnioskiem o opinię w zakresie zarządzania, dystrybucji oraz korzystania z niektórych leków w ramach tego programu państwom członkowskim.
Wnioski te kierowane są do Komisji Produktów Leczniczych Stosowanych u Ludzi (ang. European Medicines Agency’s Committee for Medicinal Products for Human Use, CHMP) [9].
Zastosowanie leku na imienny wniosek
Inna formą wczesnego dostępu jest tzw. zastosowanie leku na imienny wniosek, które reguluje art. 5 Dyrektywy 2001/83/EC. Podobnie jak w przypadku zastosowania podyktowanego współczuciem tutaj również mamy do czynienia z lekami, które najczęściej nie zostały jeszcze dopuszczone do obrotu. Istnieją jednak dwie podstawowe różnice.
Po pierwsze, z inicjatywą o udostępnienie leku dla konkretnego pacjenta występuje lekarz prowadzący bezpośrednio do producenta. Po drugie, lek nie musi spełniać wymagań rejestracji centralnej, a także w momencie składania wniosku być przedmiotem badania klinicznego.
Istotne jest jednak, aby zamówienie złożone było w dobrej wierze, zgodnie ze specyfikacją przygotowaną przez lekarza prowadzącego leczenie i na jego bezpośrednią osobistą odpowiedzialność [8].
Programy rozszerzonego dostępu
Ciekawą opcję stanowią także programy rozszerzonego dostępu, w ramach których pacjenci również mogą uzyskać dostęp do leków niedopuszczonych do obrotu. W tym przypadku jednak programy dedykowane są osobom, które ze względu na korzyść kliniczną chcą kontynuować leczenie rozpoczęte w ramach badania klinicznego.
W konsekwencji stosowane są najczęściej w przypadku terapii chorób przewlekłych. Mimo wyraźnych różnic między poszczególnymi krajami członkowskimi programy tego typu są najczęściej rejestrowane przez władze krajowe w analogicznym do badań klinicznych trybie.
Należy w tym miejscu podkreślić, że wszystkie opisane wyżej mechanizmy wczesnego dostępu nie zostały nadal uregulowane w przepisach polskiego prawa.
Problem ten został jednak dostrzeżony przez krajowego ustawodawcę i znalazł się na liście zadań, których realizację zakłada Plan dla Chorób Rzadkich przyjęty uchwałą Rady Ministrów z dnia 24 sierpnia 2021 roku [10].
Biorąc pod uwagę fakt, że zadania Planu dla Chorób Rzadkich realizowane są dotychczas z pewnym opóźnieniem, na krajowe regulacje dotyczące programów wczesnego dostępu przyjdzie nam niestety jeszcze poczekać.
Podsumowanie
Choroby rzadkie stanowią bez wyjątku wyzwanie dla każdego systemu opieki zdrowotnej. Traktowane indywidualnie wydają się mieć marginalny wpływ na system, kiedy jednak zastosujemy podejście holistyczne okazuje się, że jedynie w Polsce na choroby rzadkie cierpi od 2 do 3 milionów osób.
Choć na przestrzeni ostatnich 40 lat sytuacja chorych i ich rodzin uległa diametralnej zmianie, w dalszym ciągu wiele obszarów stanowi niezaspokojoną potrzebę medyczną.
O ile w przypadku chorób, na które nie ma jeszcze jakichkolwiek opcji terapeutycznych znaczenie odgrywają wszelkiego rodzaju inicjatywy międzynarodowe, o tyle na poziomie krajowym ważne jest każde działanie, które zwiększa możliwości terapeutyczne, przybliżając je do międzynarodowych standardów. W ostatecznym rozrachunku to pacjent powinien być dla nas najważniejszy.
Autor:
Mateusz Wołkowicz
International Market Manager
Key Products Department Urtica Sp. z o.o.
Dowiedz się więcej:
Rola medycyny personalizowanej w zapewnieniu efektywnej terapii pacjentów
Skuteczność leczenia chorób rzadkich
Źródła:
- Orphan Drug Act of 1983. 1983.
- Regulation (EC) No 141/2000 of the European Parliament and of the Council of 16 December 1999 on orphan medicinal products. 1999.
- Act on Securing Quality, Efficacy and Safety of Products including Pharmaceuticals and Medical Devices. 1993.
- Therapeutic Goods Regulations. 1997.
- Neez Emilie, Gentilini Arianna i Hutchings Adam. Addressing unmet needs in extremely rare and paediatric-onset diseases: how the biopharmaceutical innovation model can help identify current issues and find potential solutions. 2021.
- IQVIA. EFPIA Patients W.A.I.T. Indicator 2021 Survey. 2022. https://www.efpia.eu (dostęp 27.02.2023).
- Ustawa z dnia 7 października 2020 r. o Funduszu Medycznym.
- Regulation (EC) No 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agen. 2004.
- Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use. 2001.
- Uchwała nr 110 Rady Ministrów z dnia 24 sierpnia 2021 r. w sprawie przyjęcia dokumentu Plan dla Chorób Rzadkich. 2021.


